『化学㉘』元素周期表の原子と電子配置 河東丈二
- nakata513
- 2022年12月26日
- 読了時間: 8分
更新日:2022年12月27日
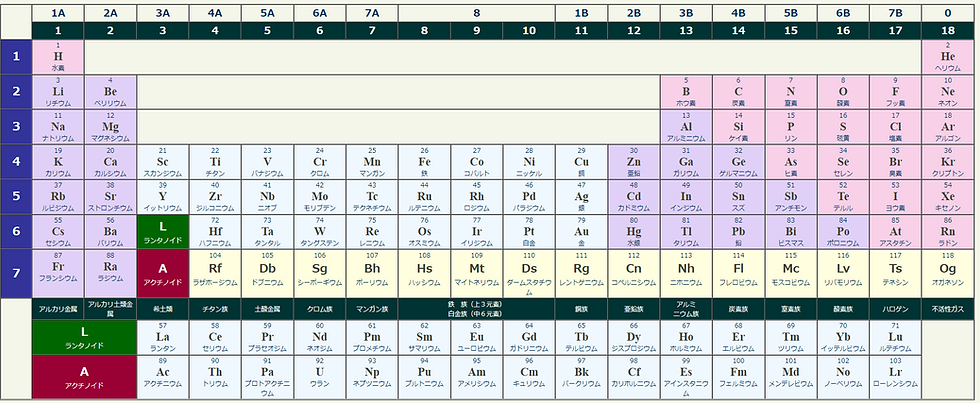

皆さんは中学の時、語呂合わせで暗黙に周期表を覚えてたことを記憶してますか?
『水兵リーベ僕の船 名前あるシップスクラークか』元素周期を
スイ(水素H)ヘイ(ヘリウムHe)リー(リチウムLi)ベ(ベリリウムBe)
ボ(ホウ素B)ク(炭素C)ノ(窒素N、酸素O)フ(フッ素F)ネ(ネオンNe)
ナ(ナトリウムNa)マエ(マグネシウムMg)アル(アルミニウムAl)シッ(ケイ素Si)プ(リンP)ス(硫黄S)
クラ(塩素Cl)ー(アルゴンAr)ク(カリウムK)カ(カルシウムCa)
理系のみならず、自国歴史と世界史においても年代暗記が大事で、何でそういうことが起きたかは考えてない。『仏教が伝わった年なんて関係なく、平家がつぶれた年も関係なく、何故あのせこい朝鮮半島から仏教を伝えたのか、それも無償で?平家がつぶれた原因は?』など考える教育をすべきである。
こういう暗黙な教育は日本のみならず、アジア圏全体の問題であり、物ことを考える力を養うことのできない教育だということはアジア圏に出張行く度に痛感する。
その反面、アメリカ・ヨーロッパの10代の学生たちとは歴史討論をしても、対等に自分の意見を述べられる、それだけで欧米教育が日本の教育より優れてるとは言えませんが。
日本はそれでも救われてることは、あったことを事実に教える、ほかのアジアの国々はありもないファンタジー歴史を教えるので、根拠のない自信に溢れる悲しい人々が多い。
元素の周期表を語呂合わせで暗記するのも大事だけど、中身である原子・電子配置・金属元素の仕組みなどを考えながら覚えた方が応用が利く。
原子
原子は、中心に正の電荷を持つ原子核とその周りを飛び回っており負の電荷を持つ電子からできています。原子核は正の電荷を持った陽子と電荷を持たない中性子からできています。その、原子核中の陽子数を原子番号といいます。原子核の周りを回る電子の道筋(正確には電子の動き回るところ)を電子軌道と呼びます。電子は、軌道が平面ではなく球状で立体的なのでその軌道を殻(電子殻)とも呼んでいます。
周期番号
電子の軌道(電子殻)は、大きい区分として内側から順に、K殻、L殻、M殻...と層状になっています。これを、主殻といいます。周期番号は、この電子殻の数をあらわしています。同周期の原子では、原子番号が大きくなるほど原子核の電荷が大きくなって電子が強く引きつけられるため原子半径は少し小さくなります。
電子配置
電子殻は、さらに s,p,d,fなどといった軌道があります。K殻は 1s軌道、L殻は 2s,2p軌道、M殻は 3s,3p,3d軌道に細分されます。これを、副殻といいます。この軌道は、軌道の形態によって分類されており、s軌道は対称な球形(1種類)、p軌道はxyzの各軸方向へ伸びた形(px、py、pzの3種類)をしています。1s、2sなどの数字は、内側からの順番につけたもので、1がK殻、2がL殻にあることを表しています。これらの軌道には、それぞれ2個の電子を収容できます。(s軌道は2個、p軌道は2x3=6個の電子がはいる)

族番号
族番号の1の位の数字が最外殻電子数を示します。以前、典型元素にAと遷移元素にBをつけて区別していたが、1989年に国際純正応用化学連合会(IUPAC)の無機化学命名法の改訂にともなって周期表の族の名称,番号の表記方法が1〜18族に改められられた。アメリカでは今でも区別している。同族の原子では、周期が大きくなるほど外側の電子殻に電子が入るため原子半径は大きくなります。
典型金属元素
金属元素のうち、遷移金属の系列にない物です。典型元素は、電子が最外殻に配置されていきます。つまり、電子が最外殻の軌道(s軌道,p軌道) に順次配置され金属としての特有の性質を持します。
典型非金属元素
非金属とは、その名の通り「金属ではない」という意味です。したがって、ここに分類される元素は金属結合を行わず金属に特有の性質を持ちません。単体では、気体である物が半分ぐらいあり電導性を持ちません。(炭素などの例外はある)典型元素は、電子が最外殻に配置されていきます。
遷移金属元素
遷移元素は全て金属元素です。遷移元素は、電子が最外殻に配置されずに内側の軌道(d軌道,f軌道)配置されていきます。遷移元素のうち、電子が 4f軌道に配置されていくものをランタノイド、5f軌道に配置されていくものをアクチノイドといいます。
ランタノイドとアクチノイド
ランタノイド(lanthanoid)とは、元素周期表上で、ランタン(No.57, La)~ルテチウム(No. 71, Lu)までの15種類をまとめた総称です。 希土類研究者の間では微妙な用語の使い分けがしばしば取りざたされます。
Actinide (アクチノイド)は原子番号89のアクチニウムから103のローレンシウムまでの15元素群のことをアクチノイドといいます。 原子番号90のトリウム、91のプロトアクチニウム、92のウランは、天然に存在するアクチノイドです。
今の世の中、周期表は化学のあらゆる分野で、反応の分類や体系化および比較を行うための枠組みを与えるものとして汎用的に用いられている。 そして、化学だけでなく物理学、生物学、化学工学を中心に工学全体に、多くの法則を示す表として用いられる。
特に我々の業界(樹脂・ゴム・シリコン)で材質の応用では避けて通れない道である。
Atom and Electron Configuration of the Periodic Table of the Elements
atom Joji Kawahigash
Do you remember that when you were in junior high school, you implicitly memorized the periodic table with puns?
``Suihei Ribe bokuno fune Namae aru Ships Clark ka?'' The elemental cycle
Sui (Hydrogen H) Hei (Helium He) Ri (Lithium Li) Be (Beryllium Be)
Bo (Boron B) Ku(Carbon C) No (Nitrogen N, Oxygen O) Fu (Fluorine F) Ne (Neon Ne)
Na (Sodium Na) Mae (Magnesium Mg) Aruka(Aluminum Al) Si (Silicon Si) Pu (Phosphorus P) Su (Sulfur S)
Cl (chlorine Cl) - (argon Ar) ku (potassium K) ka (calcium Ca)
Not only in science, but also in the history of one's own country and world history, it is important to memorize the chronology, so I don't think about why such a thing happened. 『“Regardless of the year Buddhism was introduced, regardless of the year, the Heike clan collapsed, why did Buddhism come from that small and stingy Korean peninsula? What caused the Heike collapse? 』 should be educated.
This kind of tacit education is a problem not only in Japan, but in the entire Asian region, and every time I go on a business trip to the Asian region, I am keenly aware that it is an education that does not cultivate the ability to think about things.
On the other hand, I can't say that Western education is superior to Japanese education just because of American and European teenage students can express their opinion on history.
Japan still teaches the fact that it was saved, and other Asian countries teach nonsense fantasy history, so there are many sad people full of unfounded confidence.
It's important to memorize the periodic table of the elements using puns, but it's more useful to memorize the content while thinking about the structure of atoms, electron configurations, and metal elements.
An atom consists of a nucleus with a positive charge in the center and electrons with a negative charge flying around it. The nucleus is made up of positively charged protons and uncharged neutrons. The number of protons in the nucleus is called the atomic number. The path of electrons revolving around the nucleus (more precisely, the place where electrons move around) is called the electron orbit. Since the orbital of an electron is not planar but spherical and three-dimensional, the orbital is also called a shell (electron shell).
cycle number
The orbitals of electrons (electron shells) are layered in order from the inside as K shells, L shells, M shells, etc. as large divisions. This is called the main shell. The period number indicates the number of electron shells. For atoms with the same period, the larger the atomic number, the larger the nuclear charge and the stronger the attraction of electrons, so the atomic radius becomes a little smaller.
electron configuration
The electron shell also has orbitals such as s, p, d, and f. The K shell is subdivided into 1s orbitals, the L shell into 2s, 2p orbitals, and the M shell into 3s, 3p, 3d orbitals. This is called the subshell. These orbitals are classified according to the shape of the orbitals. The s-orbital has a symmetrical spherical shape (one type), and the p-orbital has a shape extending in the xyz axis directions (three types of px, py, and pz). . Numbers such as 1s and 2s are in order from the inside, with 1 representing the K shell and 2 representing the L shell. Each of these orbitals can accommodate two electrons. (S orbital contains 2 electrons, p orbital contains 2x3=6 electrons)
Group(family) number
The one-digit number in the group number indicates the number of outermost electrons. In the past, A was assigned to main group elements and B was assigned to transition elements. The notation method has been changed to groups 1 to 18. In the United States, the distinction is still made. In the same group of atoms, the larger the period, the larger the atomic radius because electrons enter the outer electron shell.
typical metal element
It is a metal element that is not in the series of transition metals. In typical elements, the electrons are arranged in the outermost shell. In other words, the electrons are sequentially arranged in the outermost orbital (s orbital, p orbital) and have the unique properties of a metal.
typical nonmetallic elements
Non-metal, as the name suggests, means "not metal". Therefore, the elements classified here do not form metallic bonds and do not have properties unique to metals. By itself, about half of it is gaseous and does not have electrical conductivity. Electrons are arranged in the outermost shell of typical elements (with exceptions such as carbon).
transition metal element
All transition elements are metallic elements. In transition elements, electrons are not arranged in the outermost shell, but are arranged in inner orbitals (d orbitals, f orbitals). Among the transition elements, those whose electrons are arranged in his 4f orbitals are called lanthanides, and those whose electrons are arranged in his 5f orbitals are called actinides.
Lanthanides and actinides
Lanthanoid is a general term that summarizes 15 types from lanthanum (No. 57, La) to lutetium (No. 71, Lu) on the periodic table of elements. Rare earth researchers often discuss the use of subtle terminology.
Actinide is a group of 15 elements from actinium with atomic number 89 to lawrencium with atomic number 103. Thorium, atomic number 90, protactinium, 91, and uranium, 92, are naturally occurring actinides.
In today's world, the periodic table is commonly used in all areas of chemistry to provide a framework for classifying, organizing and comparing reactions. It is used not only in chemistry but also in physics, biology, chemical engineering, and other engineering as a table showing many laws.
Especially in our industry (resin, rubber, silicon), it is an unavoidable path in the application of materials.



コメント