『化学㉖』元素周期表の大切さ 河東丈二
- nakata513
- 2022年12月15日
- 読了時間: 6分

周期表 (periodic table) 元素の性質が周期的に変化することを元素の周期律という。 周期律を利用して、原子を原子番号の順に並べ、性質の類似した元素が縦に並ぶように配列した表を周期表という。 最初の周期表は1869年、メンデレーエフによって発表された。
元素の類似性と周期性が規則正しく表現された周期表を、研究者はどのように活用しているのでしょうか。
たくさんの元素が規則正しく並ぶ周期表ですが、メンデレーエフが周期律を見出したときは未完成の状態でした。当時は、まだ見つかっていない元素がたくさんあり、それらを空欄にしたまま周期表を作成しました。メンデレーエフは酸素や窒素などの限られた元素の情報だけで、周期律を見出し、「まだ見つかっていない元素も原理的には周期表のルールにあてはまるのではないか」と予測したのです。最初は空白だらけの周期表でしたが、新たな元素が見つかるたびに改良され、現在のかたちになりました。
たった一つの表にさまざまな規則性が隠れている
原子の構造
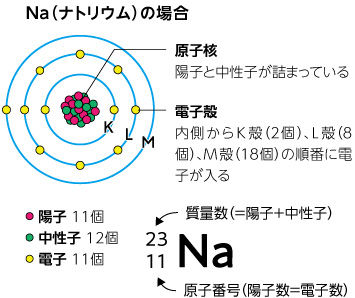
原子の内部には陽子と中性子とで構成される原子核があり、陽子と同じ数の電子がそのまわりを飛び回っています。だいじなのは〈陽子の数〉。周期表の元素は、陽子の数(=原子番号=電子数)の順に並んでいます(例えば、水素は1個、ヘリウムは2個の陽子をもちます)。
族と周期
横の列を〈周期〉、縦の列を〈族〉と呼びます。同じ周期・族に位置する元素どうしは、性質が類似しています。また、同じ族にある元素どうしでも、周期が違えば性質は微妙に異なるのです。それぞれの元素の性質を各論的に知ることもだいじですが、この縦糸と横糸の関係性を俯瞰して勉強すると、周期表の奥深さがより理解できますよ。

原子半径(原子の大きさ)
最外殻の電子が外側にあればあるほど、原子半径は大きくなります。また、原子核のなかの陽子数が多いほど(周期の右側にある元素ほど)、電子を引き付ける力が強く、原子半径が小さくなります。


電気陰性度(電子を引き付ける力の強さ)
電気陰性度が大きい原子は、結合している原子と共有している電子(共有電子対)を自分の側に引き寄せます。周期表の右上に位置するほど大きく、左下に位置するほど小さくなる傾向があります。 ※18族の希ガスの元素は過不足なく電子が存在し、単独の原子で安定しているため、電気陰性度の定義がない。


原子価(ほかの原子と結合できる手の数)
結合に関与する箇所に、原子がもっている電子の数です。結合をつくったときの幾何構造は、元素どうしの性質により変化しますが、原子価は分子のかたちを決定づける要素です。また、一つの元素で複数の異なる原子価をとることができる元素は多く存在します。


私が化学の勉強を始めた令和3年9月からずっと勉強しているのは、有機化合物に多様な典型元素(1、2族および12~18族に属する元素)を組み込んだ〈新しい〉物質。それらのデザイン、合成法の開発、性質の理解、そして機能性材料としての可能性の追求まで、多岐にわたる研究に取り組んできました。 ゴム工場時代に注目した元素はSi(ケイ素)。有機化合物で中心となるC(炭素)の代わりに、Siどうしの結合をもつ化合物の性質を理解するための基礎勉強に取り組みました。そののちに今の会社を設立し、新しく勉強を始める際に、P(リン)に注目しました。Pの特性を生かして、優れた機能性有機材料にまでつながった研究は数えるほどありました。「Pの特性をみつめ直し、最大限に引き出すための適切な分子デザインができれば、スゴい材料ができるのではないか」と信じて、勉強に取り組むことに。そいつかは、優れた性能をもつ蛍光色素や二光子吸収色素、さらには単一分子エレクトロニクスまで、じつにさまざまなユニークな機能性材料の開発したいです。 これらの勉強を進める過程で、標的分子の合成部分にはずいぶん苦労していますが、ゴム工場時代から続けたSiの勉強で培った経験がとても役立ったのです。SiとPは同じ周期にある「おとなりさん」なので、反応性が似ている。こういうところにも、周期表は大いに役立ています。
The Importance of the Periodic Table of Elements Joji Kawahigashi
Periodic table The periodic table of elements is called the periodic table of elements. The periodic table is a table in which atoms are arranged in order of atomic number using the periodic law so that elements with similar properties are arranged vertically. The first periodic table was published by Mendeleev in 1869.
How do researchers use the periodic table, which regularly expresses the similarities and periodicities of elements?
The periodic table is an orderly array of many elements, but it was incomplete when Mendeleev discovered the periodic law. At that time, there were many elements that had not yet been discovered, so I left them blank when creating the periodic table. Mendeleev discovered the periodic law based on limited information about elements such as oxygen and nitrogen, and predicted that, in principle, the rules of the periodic table would apply to elements that have not yet been discovered. At first it was a periodic table full of blanks, but it was improved every time a new element was discovered, and it became the current form.
Various regularities are hidden in a single table
atomic structure
Inside an atom is a nucleus made up of protons and neutrons, with the same number of electrons as protons circling around it. The key is <the number of protons>. Elements in the periodic table are arranged in order of the number of protons (atomic number = number of electrons) (for example, hydrogen has one proton and helium has two protons).
family and cycle
The horizontal column is called "period" and the vertical column is called "family". Elements in the same period and group have similar properties. In addition, even elements in the same group have slightly different properties if their periods are different. It is important to know the properties of each element in detail, but if you study the relationship between the warp and weft from a bird's-eye view, you will be able to understand the depth of the periodic table.
atomic radius (atomic size)
The further out the outermost electron is, the larger the atomic radius. Also, the greater the number of protons in the nucleus (elements on the right side of the period), the stronger the force that attracts electrons and the smaller the atomic radius.
electronegativity (strength of force that attracts electrons)
Atoms with high electronegativity attract to themselves the electrons they share with the atoms they are bonded to (shared electron pairs). It tends to be larger in the upper right corner of the periodic table and smaller in the lower left corner.
*There is no definition of electronegativity because the elements of Group 18 noble gases have just the right amount of electrons and are stable as single atoms.
Valence (number of hands that can bond with other atoms)
It is the number of electrons that an atom has at the point involved in bonding. The geometric structure of a bond changes depending on the properties of the elements, but the valence is the factor that determines the shape of the molecule. In addition, there are many elements that can have multiple different valences in one element.
Since I started studying chemistry in September 2021, I have been studying <new> that incorporates various typical elements (elements belonging to groups 1, 2 and 12 to 18) into organic compounds. material. We have been engaged in a wide range of research, from their design, development of synthesis methods, understanding of their properties, and pursuit of their potential as functional materials. The element that attracted attention during the rubber factory era was Si (silicon). I worked on basic studies to understand the properties of compounds that have Si-Si bonds instead of C (carbon), which is the core of organic compounds. After that, when I established my current company and started studying again, I focused on P (Lin). There have been countless studies that have led to excellent functional organic materials by making use of the properties of P. I decided to start studying, believing that if I could reexamine the properties of P and create an appropriate molecular design to maximize it, I might be able to create an amazing material. He wants to develop a wide variety of unique functional materials, such as fluorescent dyes, two-photon absorption dyes, and even single-molecule electronics with excellent performance. In the process of studying these subjects, I had a lot of trouble with the synthesis of the target molecule, but the experience I had gained from studying Si since my days at the rubber factory was very useful. Since Si and P are "neighbors" in the same period, their reactivity is similar. The periodic table is very useful here.



コメント